
سرطان الدم الليمفاوي الحاد عند الأطفال
سرطان الدم الليمفاوي الحاد في مرحلة الطفولة
في هذه الصفحة:
- معلومات عامة عن سرطان الدم الليمفاوي الحاد في مرحلة الطفولة
- مجموعات الخطر لسرطان الدم الليمفاوي الحاد في مرحلة الطفولة
- نظرة عامة على خيار العلاج
- علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (خطر معياري)
- علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (مخاطر عالية)
- علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (خطورة عالية جدًا)
- علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (مجموعات خاصة)
- علاج سرطان الدم الليمفاوي الحاد المعندة والناكسة في مرحلة الطفولة
- لمعرفة المزيد عن سرطان الدم الليمفاوي الحاد في مرحلة الطفولة
معلومات عامة عن سرطان الدم الليمفاوي الحاد في مرحلة الطفولة
النقاط الرئيسية
- ابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة (ALL) هو نوع من السرطان يصنع فيه نخاع العظم عددًا كبيرًا جدًا من الخلايا الليمفاوية غير الناضجة (نوع من خلايا الدم البيضاء).
- قد يؤثر اللوكيميا على خلايا الدم الحمراء وخلايا الدم البيضاء والصفائح الدموية.
- يؤثر العلاج السابق للسرطان وبعض الحالات الوراثية على خطر تطور ALL.
- تشمل علامات ALL الحمى والكدمات.
- تستخدم الاختبارات التي تفحص الدم ونخاع العظام لتشخيص ALL.
- تؤثر عوامل معينة على الإنذار (فرصة الشفاء) وخيارات العلاج.
ابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة (ALL) هو نوع من السرطان يصنع فيه نخاع العظم عددًا كبيرًا جدًا من الخلايا الليمفاوية غير الناضجة (نوع من خلايا الدم البيضاء).
ابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة (يُسمى أيضًا ابيضاض الدم اللمفاوي الحاد أو ALL)
هو سرطان الدم ونخاع العظام . عادة ما يتفاقم هذا النوع من السرطان بسرعة إذا لم يتم علاجه.
تكبير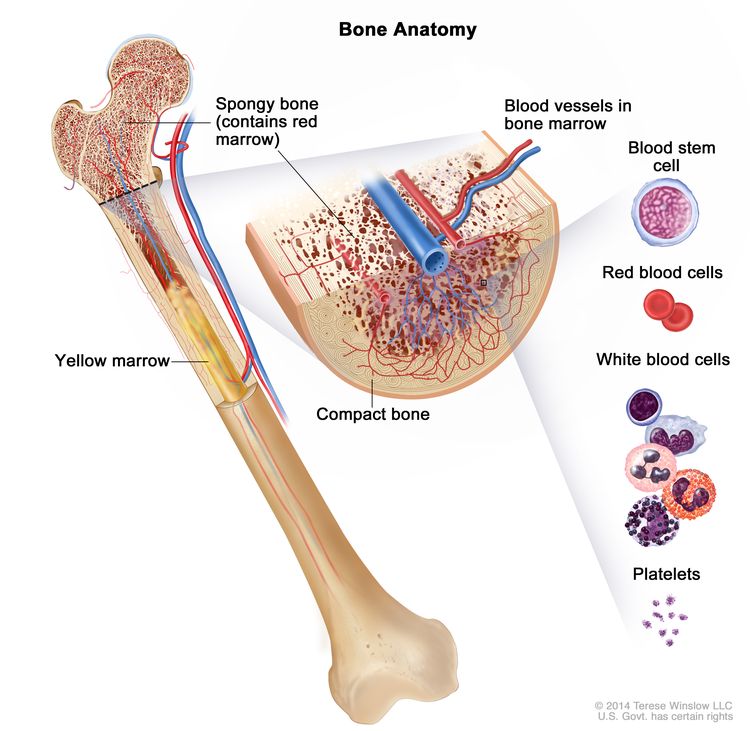 تشريح العظام. يتكون العظم من عظم مضغوط وعظم إسفنجي ونخاع عظمي. يشكل العظم المضغوط الطبقة الخارجية للعظم. يوجد العظم الإسفنجي في الغالب في نهايات العظام ويحتوي على نخاع أحمر. يوجد نخاع العظم في وسط معظم العظام وله العديد من الأوعية الدموية. هناك نوعان من نخاع العظام: الأحمر والأصفر. يحتوي النخاع الأحمر على خلايا الدم الجذعية التي يمكن أن تصبح خلايا الدم الحمراء أو خلايا الدم البيضاء أو الصفائح الدموية. يتكون النخاع الأصفر في الغالب من الدهون.
تشريح العظام. يتكون العظم من عظم مضغوط وعظم إسفنجي ونخاع عظمي. يشكل العظم المضغوط الطبقة الخارجية للعظم. يوجد العظم الإسفنجي في الغالب في نهايات العظام ويحتوي على نخاع أحمر. يوجد نخاع العظم في وسط معظم العظام وله العديد من الأوعية الدموية. هناك نوعان من نخاع العظام: الأحمر والأصفر. يحتوي النخاع الأحمر على خلايا الدم الجذعية التي يمكن أن تصبح خلايا الدم الحمراء أو خلايا الدم البيضاء أو الصفائح الدموية. يتكون النخاع الأصفر في الغالب من الدهون.
يعد ALL هو أكثر أنواع السرطانات شيوعًا عند الأطفال.
قد تؤثر اللوكيميا على خلايا الدم الحمراء وخلايا الدم البيضاء والصفائح الدموية.
في الطفل السليم ، يصنع النخاع العظمي خلايا الدم الجذعية (الخلايا غير الناضجة ) التي تصبح خلايا دم ناضجة بمرور الوقت. قد تصبح الخلية الجذعية في الدم خلية جذعية نخاعية أو خلية جذعية ليمفاوية .
تصبح الخلية الجذعية النخاعية واحدة من ثلاثة أنواع من خلايا الدم الناضجة:
- خلايا الدم الحمراء التي تحمل الأكسجين والمواد الأخرى إلى جميع أنسجة الجسم.
- الخلايا الحبيبية ، وهي خلايا الدم البيضاء التي تساعد في مكافحة العدوى والأمراض.
- الصفائح الدموية التي تشكل جلطات دموية لوقف النزيف.
تصبح الخلية الجذعية اللمفاوية خلية أرومة ليمفاوية ثم واحدة من ثلاثة أنواع من الخلايا الليمفاوية (خلايا الدم البيضاء):
- الخلايا الليمفاوية B التي تصنع الأجسام المضادة للمساعدة في مكافحة العدوى.
- الخلايا الليمفاوية التائية التي تساعد الخلايا الليمفاوية B على صنع الأجسام المضادة التي تساعد في مكافحة العدوى.
- الخلايا الطبيعية القاتلة التي تهاجم الخلايا السرطانية والفيروسات .
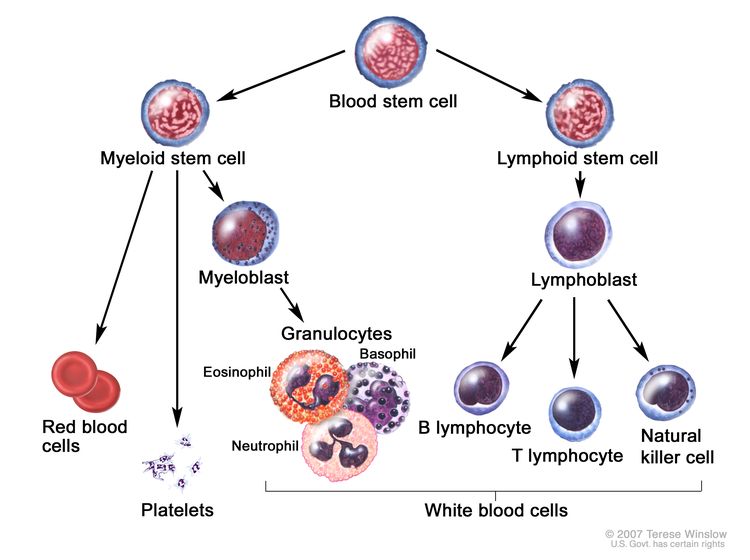 تطور خلايا الدم. تمر خلية الدم الجذعية بعدة خطوات لتصبح خلية دم حمراء أو صفيحة أو خلية دم بيضاء.
تطور خلايا الدم. تمر خلية الدم الجذعية بعدة خطوات لتصبح خلية دم حمراء أو صفيحة أو خلية دم بيضاء.
عند الطفل المصاب بـ ALL ، تصبح العديد من الخلايا الجذعية أرومات ليمفاوية أو خلايا لمفاوية ب أو خلايا لمفاوية تائية. تسمى هذه الخلايا أيضًا بخلايا اللوكيميا . لا تعمل خلايا سرطان الدم هذه مثل الخلايا الليمفاوية الطبيعية وغير قادرة على محاربة العدوى بشكل جيد. أيضًا ، نظرًا لزيادة عدد خلايا سرطان الدم في الدم ونخاع العظام ، هناك مساحة أقل لخلايا الدم البيضاء وخلايا الدم الحمراء والصفائح الدموية السليمة. قد يؤدي ذلك إلى الإصابة بالعدوى وفقر الدم والنزيف السهل.
يدور هذا الملخص حول ابيضاض الدم الليمفاوي الحاد لدى الأطفال والمراهقين والشباب.
يؤثر العلاج السابق للسرطان وبعض الحالات الوراثية على خطر إصابة الأطفال بـ ALL.
يُطلق على أي شيء يزيد من خطر إصابتك بمرض عامل خطر . وجود عامل خطر لا يعني أنك ستصاب بالسرطان ؛ عدم وجود عوامل خطر لا يعني أنك لن تصاب بالسرطان. تحدث مع طبيب طفلك إذا كنت تعتقد أن طفلك قد يكون في خطر.
تشمل عوامل الخطر المحتملة لـ ALL ما يلي:
- التعرض للأشعة السينية قبل الولادة.
- التعرض للإشعاع .
- العلاج السابق بالعلاج الكيميائي .
- الإصابة بحالات وراثية معينة ، مثل:
- متلازمة داون .
- الورم العصبي الليفي من النوع 1 .
- متلازمة بلوم .
- فقر الدم فانكوني .
- رنح توسع الشعيرات .
- متلازمة لي فروميني .
- طفرات في جينات معينة تمنع الحمض النووي من إصلاح نفسه ، مما يؤدي إلى نمو السرطانات في سن مبكرة).
- حدوث تغييرات معينة في الكروموسومات أو الجينات.
تشمل علامات ALL عند الاطفال الحمى والكدمات.
قد تحدث هذه العلامات والأعراض وغيرها
بسبب ALL أو بسبب حالات أخرى. استشر طبيب طفلك إذا كان لدى طفلك أي مما يلي:
- حمى .
- سهولة حدوث كدمات أو نزيف.
- نمشات (بقع مسطحة ومحددة وذات لون أحمر داكن تحت الجلد ناتجة عن النزيف).
- الضعف والشعور بالتعب أو الشحوب.
- آلام العظام أو المفاصل .
- ضيق في التنفس.
- كتل غير مؤلمة (تضخم الغدد الليمفاوية ) في الرقبة أو الإبط أو المعدة أو الفخذ .
- ألم أو شعور بالامتلاء تحت الضلوع.
- فقدان الشهية .
تستخدم الاختبارات التي تفحص الدم ونخاع العظام لتشخيص ALL.
يمكن استخدام الاختبارات والإجراءات التالية لتشخيص مرض ALL ومعرفة ما إذا كانت خلايا سرطان الدم قد انتشرت إلى أجزاء أخرى من الجسم مثل الدماغ أو الخصيتين :
- الفحص البدني والتاريخ الصحي : فحص للجسم للتحقق من العلامات العامة للصحة ، بما في ذلك التحقق من علامات المرض ، مثل الكتل أو أي شيء آخر يبدو غير عادي. سيتم أيضًا أخذ تاريخ من العادات الصحية للمريض والأمراض والعلاجات السابقة.
- تعداد الدم الكامل (CBC) مع التفاضل : إجراء يتم فيه سحب عينة من الدم وفحصها فيما يلي:
تكبير
- عدد خلايا الدم الحمراء والصفائح الدموية.
- عدد خلايا الدم البيضاء ونوعها.
- كمية الهيموجلوبين الذي يحمل الأكسجين في خلايا الدم الحمراء.
- يتكون جزء العينة من خلايا الدم الحمراء.
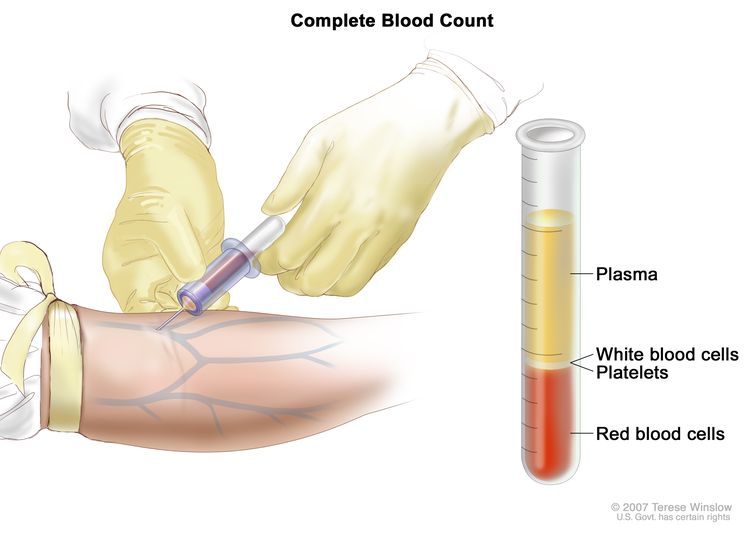 تعداد الدم الكامل (CBC). يتم جمع الدم عن طريق إدخال إبرة في الوريد والسماح للدم بالتدفق في أنبوب. يتم إرسال عينة الدم إلى المختبر ويتم عد خلايا الدم الحمراء وخلايا الدم البيضاء والصفائح الدموية. يتم استخدام CBC لاختبار العديد من الحالات المختلفة وتشخيصها ومراقبتها.
تعداد الدم الكامل (CBC). يتم جمع الدم عن طريق إدخال إبرة في الوريد والسماح للدم بالتدفق في أنبوب. يتم إرسال عينة الدم إلى المختبر ويتم عد خلايا الدم الحمراء وخلايا الدم البيضاء والصفائح الدموية. يتم استخدام CBC لاختبار العديد من الحالات المختلفة وتشخيصها ومراقبتها. - دراسات كيمياء الدم : إجراء يتم فيه فحص عينة الدم لقياس كميات بعض المواد التي تطلقها الأعضاء والأنسجة في الدم في الدم. يمكن أن تكون الكمية غير المعتادة (أعلى أو أقل من المعتاد) من مادة ما علامة على المرض.
- شفط وخزعة نخاع العظم : إزالة نخاع العظم وقطعة صغيرة من العظم عن طريق إدخال إبرة مجوفة في عظم الورك أو عظم الصدر . يقوم أخصائي علم الأمراض بفحص نخاع العظام والعظام تحت المجهر للبحث عن علامات الإصابة بالسرطان.تكبير
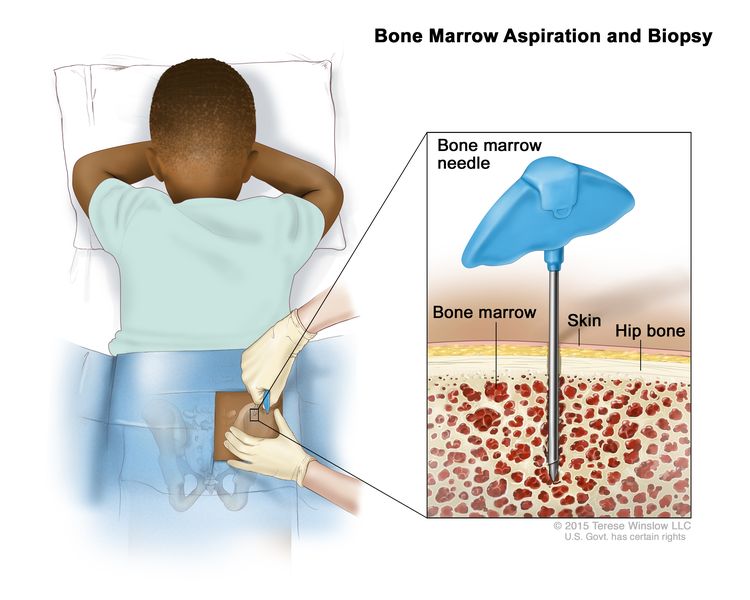 شفط وخزعة نخاع العظم. بعد تخدير منطقة صغيرة من الجلد ، يتم إدخال إبرة نخاع العظم في عظم ورك الطفل. يتم أخذ عينات من الدم والعظام ونخاع العظام لفحصها تحت المجهر.
شفط وخزعة نخاع العظم. بعد تخدير منطقة صغيرة من الجلد ، يتم إدخال إبرة نخاع العظم في عظم ورك الطفل. يتم أخذ عينات من الدم والعظام ونخاع العظام لفحصها تحت المجهر.
تُجرى الاختبارات التالية على الدم أو أنسجة نخاع العظم التي تمت إزالتها:
- التحليل الوراثي الخلوي : اختبار معملي يتم فيه عد كروموسومات الخلايا في عينة من الدم أو نخاع العظم وفحصها بحثًا عن أي تغييرات ، مثل الكروموسومات المكسورة أو المفقودة أو المعاد ترتيبها أو الزائدة. قد تكون التغييرات في كروموسومات معينة علامة على الإصابة بالسرطان. على سبيل المثال ، في فيلادلفيا كروموسوم - موجب ALL ، جزء من تبديل كروموسوم واحد مع جزء من كروموسوم آخر. وهذا ما يسمى "كروموسوم فيلادلفيا". يستخدم التحليل الوراثي الخلوي للمساعدة في تشخيص السرطان أو التخطيط للعلاج أو معرفة مدى نجاح العلاج.تكبير
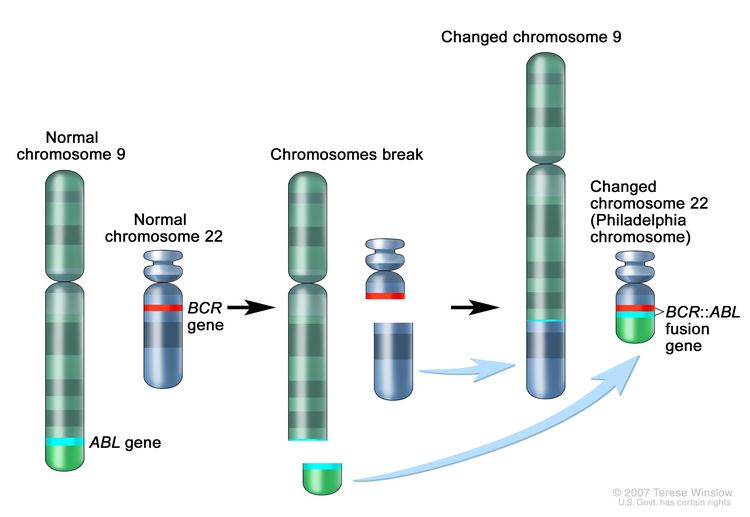 فيلادلفيا كروموسوم. قطعة كروموسوم 9 وقطعة كروموسوم 22 تقطع وتتبادل الأماكن. يتكون الجين BCR-ABL على الكروموسوم 22 حيث تلتصق قطعة الكروموسوم 9. يسمى الكروموسوم 22 المتغير كروموسوم فيلادلفيا.
فيلادلفيا كروموسوم. قطعة كروموسوم 9 وقطعة كروموسوم 22 تقطع وتتبادل الأماكن. يتكون الجين BCR-ABL على الكروموسوم 22 حيث تلتصق قطعة الكروموسوم 9. يسمى الكروموسوم 22 المتغير كروموسوم فيلادلفيا. - التنميط المناعي :
- التحليل الوراثي الخلوي : اختبار معملي يتم فيه عد كروموسومات الخلايا في عينة من الدم أو نخاع العظم وفحصها بحثًا عن أي تغييرات ، مثل الكروموسومات المكسورة أو المفقودة أو المعاد ترتيبها أو الزائدة. قد تكون التغييرات في كروموسومات معينة علامة على الإصابة بالسرطان. على سبيل المثال ، في فيلادلفيا كروموسوم - موجب ALL ، جزء من تبديل كروموسوم واحد مع جزء من كروموسوم آخر. وهذا ما يسمى "كروموسوم فيلادلفيا". يستخدم التحليل الوراثي الخلوي للمساعدة في تشخيص السرطان أو التخطيط للعلاج أو معرفة مدى نجاح العلاج.تكبير
- هو اختبار معملي يستخدم الأجسام المضادة لتحديد الخلايا السرطانية بناءً على أنواع المستضدات
- البزل القطني : إجراء يستخدم لجمع عينة من السائل الدماغي النخاعي (CSF) من العمود الفقري . يتم ذلك عن طريق وضع إبرة بين عظمتين في العمود الفقري وداخل السائل النخاعي حول الحبل الشوكي وإزالة عينة من السائل. يتم فحص عينة السائل الدماغي النخاعي تحت المجهر بحثًا عن علامات انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي. يُطلق على هذا الإجراء أيضًا اسم LP أو البزل الشوكي.تكبير
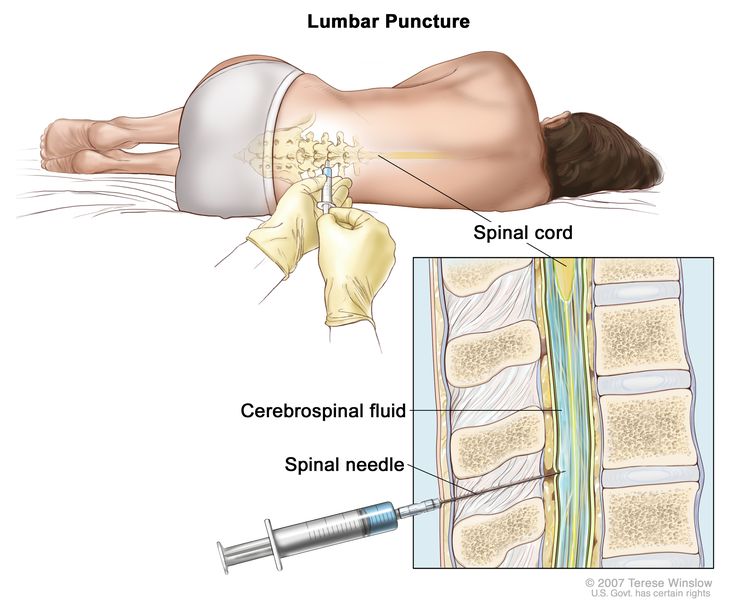 البزل القطني. مريض يرقد في وضع كرة لولبية على طاولة. بعد تخدير منطقة صغيرة في أسفل الظهر ، يتم إدخال إبرة العمود الفقري (إبرة طويلة ورفيعة) في الجزء السفلي من العمود الفقري لإزالة السائل النخاعي (السائل النخاعي ، كما هو موضح باللون الأزرق). يمكن إرسال السائل إلى المختبر للاختبار.
البزل القطني. مريض يرقد في وضع كرة لولبية على طاولة. بعد تخدير منطقة صغيرة في أسفل الظهر ، يتم إدخال إبرة العمود الفقري (إبرة طويلة ورفيعة) في الجزء السفلي من العمود الفقري لإزالة السائل النخاعي (السائل النخاعي ، كما هو موضح باللون الأزرق). يمكن إرسال السائل إلى المختبر للاختبار.
يتم إجراء هذا الإجراء بعد تشخيص سرطان الدم لمعرفة ما إذا كانت خلايا سرطان الدم قد انتشرت إلى الدماغ والحبل الشوكي. يتم إعطاء العلاج الكيميائي داخل القراب بعد إزالة عينة من السائل لعلاج أي خلايا ابيضاض الدم قد تكون قد انتشرت إلى الدماغ والحبل الشوكي.
- تصوير الصدر بالأشعة السينية : تصوير بالأشعة السينية للأعضاء والعظام داخل الصدر. الأشعة السينية هي نوع من حزمة الطاقة التي يمكن أن تمر عبر الجسم وتصنع صورة لمناطق داخل الجسم. يتم إجراء تصوير الصدر بالأشعة السينية لمعرفة ما إذا كانت خلايا سرطان الدم قد تكونت كتلة في منتصف الصدر.
تؤثر عوامل معينة على الإنذار (فرصة الشفاء) وخيارات العلاج.
يعتمد التكهن على:
- ما مدى سرعة انخفاض عدد خلايا سرطان الدم ومدى انخفاضه بعد الشهر الأول من العلاج.
- العمر وقت التشخيص والجنس والعرق.
- عدد خلايا الدم البيضاء في الدم وقت التشخيص.
- ما إذا كانت خلايا سرطان الدم قد بدأت من الخلايا الليمفاوية البائية أو الخلايا الليمفاوية التائية.
- ما إذا كانت هناك تغييرات معينة في الكروموسومات أو جينات خلايا سرطان الدم.
- ما إذا كان الطفل يعاني من متلازمة داون.
- ما إذا كانت خلايا سرطان الدم موجودة في السائل الدماغي الشوكي.
- وزن الطفل وقت التشخيص وأثناء العلاج.
تعتمد خيارات العلاج على:
- ما إذا كانت خلايا سرطان الدم قد بدأت من الخلايا الليمفاوية البائية أو الخلايا الليمفاوية التائية.
- ما إذا كان الطفل مصابًا بمخاطر قياسية أو عالية الخطورة أو عالية الخطورة جدًا.
- عمر الطفل وقت التشخيص.
- ما إذا كانت هناك تغييرات معينة في كروموسومات الخلايا الليمفاوية ، مثل كروموسوم فيلادلفيا.
- ما إذا كان الطفل قد عولج بالستيرويدات قبل بدء العلاج الأولي .
- ما مدى سرعة انخفاض عدد خلايا سرطان الدم ومدى انخفاضه أثناء العلاج.
بالنسبة لسرطان الدم الذي ينتكس (يعود) بعد العلاج ، تعتمد خيارات التشخيص والعلاج جزئياً على ما يلي:
- كم من الوقت بين وقت التشخيص ووقت عودة اللوكيميا.
- ما إذا كان سرطان الدم يعود إلى نخاع العظام أو في أجزاء أخرى من الجسم.
مجموعات الخطر لسرطان الدم الليمفاوي الحاد في مرحلة الطفولة
النقاط الرئيسية
- في ALL الاطفال، تُستخدم المجموعات المعرضة للخطر لتخطيط العلاج.
- في بعض الأحيان ، لا تستجيب حالات ALL للعلاج أو تعود بعد العلاج.
في ALL الاطفال، تُستخدم المجموعات المعرضة للخطر لتخطيط العلاج.
هناك ثلاث مجموعات معرضة للخطر في ALL الاطفال. يتم وصفها على أنها:
- الخطر القياسي (المنخفض): يشمل الأطفال الذين تتراوح أعمارهم بين 1 و 10 سنوات والذين لديهم عدد خلايا الدم البيضاء أقل من 50000 / ميكرولتر في وقت التشخيص .
- مخاطر عالية: تشمل الأطفال بعمر 10 سنوات وما فوق و / أو الأطفال الذين لديهم عدد خلايا الدم البيضاء 50.000 / ميكرولتر أو أكثر في وقت التشخيص.
- مخاطر عالية جدًا:
تشمل العوامل الأخرى التي تؤثر على مجموعة المخاطر ما يلي:
- ما إذا كانت خلايا سرطان الدم قد بدأت من الخلايا الليمفاوية البائية أو الخلايا الليمفاوية التائية .
- ما إذا كانت هناك تغييرات معينة في الكروموسومات أو جينات الخلايا الليمفاوية .
- ما مدى سرعة انخفاض عدد خلايا سرطان الدم ومدى انخفاضه بعد العلاج الأولي.
- ما إذا كانت خلايا سرطان الدم موجودة في السائل الدماغي الشوكي في وقت التشخيص.
من المهم معرفة مجموعة المخاطر من أجل التخطيط للعلاج. عادةً ما يتلقى الأطفال المصابون بمخاطر عالية أو عالية الخطورة المزيد من الأدوية المضادة للسرطان و / أو جرعات أعلى من الأدوية المضادة للسرطان مقارنة بالأطفال المصابين بمرض ابيضاض الدم اللمفاوي الحاد.
في بعض الأحيان ، لا تستجيب حالات ALL للعلاج أو تعود بعد العلاج.
ALL المعند هي سرطان لا يستجيب للعلاج الأولي.
حالات ALL المتكررة هو السرطان الذي تكرر (عاد) بعد علاجه. قد يعود سرطان الدم إلى الدم ونخاع العظام أو الدماغ أو النخاع الشوكي أو الخصيتين أو أجزاء أخرى من الجسم.
نظرة عامة على خيار العلاج
النقاط الرئيسية
- هناك أنواع مختلفة من العلاج لابيضاض الدم الليمفاوي الحاد .(ALL) في مرحلة الطفولة .
- يجب أن يتم تخطيط علاج الأطفال الذين يعانون من ALL مع فريق من الأطباء الخبراء في علاج ابيضاض الدم لدى الأطفال.
- عادة ما يتكون علاج ALL من ثلاث مراحل.
- يتم استخدام أربعة أنواع من العلاج القياسي:
- العلاج الكيميائي
- علاج إشعاعي
- العلاج الكيميائي بزرع الخلايا الجذعية
- العلاج الموجه
- يُعطى العلاج لقتل خلايا سرطان الدم التي انتشرت أو قد تنتشر إلى الدماغ أو النخاع الشوكي أو الخصيتين.
- يتم اختبار أنواع جديدة من العلاج في التجارب السريرية.
- العلاج المناعي
- قد يتسبب علاج ابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة في حدوث آثار جانبية.
- قد يرغب المرضى في التفكير في المشاركة في تجربة سريرية.
- يمكن للمرضى الدخول في التجارب السريرية قبل أو أثناء أو بعد بدء علاج السرطان.
- قد تكون هناك حاجة لاختبارات المتابعة.
هناك أنواع مختلفة من العلاج لابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة (ALL).
تتوفر أنواع مختلفة من العلاج للأطفال المصابين بابيضاض الدم الليمفاوي الحاد (ALL). تعتبر بعض العلاجات قياسية (العلاج المستخدم حاليًا) ، ويتم اختبار البعض الآخر في التجارب السريرية . التجربة السريرية العلاجية هي دراسة بحثية تهدف إلى المساعدة في تحسين العلاجات الحالية أو الحصول على معلومات حول العلاجات الجديدة لمرضى السرطان . عندما تظهر التجارب السريرية أن العلاج الجديد أفضل من العلاج القياسي ، فقد يصبح العلاج الجديد هو العلاج القياسي.
نظرًا لندرة الإصابة بالسرطان عند الأطفال ، ينبغي النظر في المشاركة في تجربة سريرية. بعض التجارب السريرية مفتوحة فقط للمرضى الذين لم يبدأوا العلاج.
يجب أن يتم تخطيط علاج الأطفال الذين يعانون من ALL مع فريق من الأطباء الخبراء في علاج ابيضاض الدم لدى الأطفال.
سيشرف على العلاج طبيب أورام الأطفال ، وهو طبيب متخصص في علاج الأطفال المصابين بالسرطان. يعمل اختصاصي أورام الأطفال مع أخصائيي صحة الأطفال الآخرين الخبراء في علاج الأطفال المصابين بسرطان الدم والمتخصصين في مجالات معينة من الطب . قد يشمل هؤلاء المتخصصين التاليين :
عادة ما يتكون علاج ALL عند الأطفال من ثلاث مراحل.
يتم علاج ALL الأطفال على مراحل:
- تحريض هدوء المرض : هذه هي المرحلة الأولى من العلاج. الهدف هو قتل خلايا سرطان الدم في الدم ونخاع العظام . هذا يضع اللوكيميا في حالة هجوع .
- التوحيد / التكثيف : هذه هي المرحلة الثانية من العلاج. يبدأ بمجرد أن يكون سرطان الدم في حالة هدوء. الهدف من العلاج التوحيد / التكثيف هو قتل أي خلايا ابيضاض الدم تبقى في الجسم وقد تسبب انتكاسة .
- الصيانة : هذه هي المرحلة الثالثة من العلاج. الهدف هو قتل أي خلايا سرطان الدم المتبقية التي قد تنمو وتسبب الانتكاس. غالبًا ما تُعطى علاجات السرطان بجرعات أقل من تلك المستخدمة أثناء تحريض الهدوء للمراض ومراحل التوحيد / التكثيف. إن عدم تناول الأدوية حسب طلب الطبيب أثناء العلاج الوقائي يزيد من فرصة عودة السرطان. وهذا ما يسمى أيضًا بمرحلة العلاج المستمر.
يتم استخدام أربعة أنواع من العلاج القياسي:
العلاج الكيميائي
العلاج الكيميائي هو علاج للسرطان يستخدم عقاقير لوقف نمو الخلايا السرطانية ، إما عن طريق قتل الخلايا أو منعها من الانقسام. عند تناول العلاج الكيميائي عن طريق الفم أو حقنه في الوريد أو العضلات ، تدخل الأدوية مجرى الدم ويمكن أن تصل إلى الخلايا السرطانية في جميع أنحاء الجسم ( العلاج الكيميائي الجهازي ). عندما يتم وضع العلاج الكيميائي مباشرة في السائل الدماغي النخاعي (داخل القراب) ، أو العضو ، أو تجويف الجسم مثل البطن ، فإن الأدوية تؤثر بشكل أساسي على الخلايا السرطانية في تلك المناطق ( العلاج الكيميائي الإقليمي ). العلاج الكيميائي المركبهو العلاج باستخدام أكثر من عقار واحد مضاد للسرطان.
تعتمد طريقة إعطاء العلاج الكيميائي على مجموعة الخطر لدى الطفل . يتلقى الأطفال المصابون بمخاطر عالية ALL عقاقير مضادة للسرطان وجرعات أعلى من الأدوية المضادة للسرطان مقارنة بالأطفال الذين يعانون من ابيضاض الدم اللمفاوي الحاد القياسي. يستخدم العلاج الكيميائي داخل القراب لعلاج جميع الأطفال الذين انتشروا ، أو قد ينتشرون ، إلى الدماغ والحبل الشوكي .
راجع العلاج الإشعاعي هو علاج للسرطان يستخدم أشعة سينية عالية الطاقة أو أنواع أخرى من الإشعاع لقتل الخلايا السرطانية أو منعها من النمو. يستخدم العلاج الإشعاعي الخارجي آلة خارج الجسم لإرسال إشعاع نحو منطقة الجسم المصابة بالسرطان.
يمكن استخدام العلاج الإشعاعي الخارجي لعلاج جميع الأطفال الذين انتشروا أو قد ينتشروا إلى الدماغ أو النخاع الشوكي أو الخصيتين . يمكن استخدامه أيضًا لتحضير نخاع العظم لعملية زرع الخلايا الجذعية .
العلاج الكيميائي بزرع الخلايا الجذعية
يُعطى العلاج الكيميائي لقتل الخلايا السرطانية. في الأطفال بعمر 3 سنوات فما فوق ، يُعطى تشعيع كامل الجسم بالعلاج الكيميائي. يتم تدمير الخلايا السليمة أيضًا ، بما في ذلك الخلايا المكونة للدم ، من خلال علاج السرطان. زرع الخلايا الجذعية هو علاج لاستبدال الخلايا المكونة للدم. تتم إزالة الخلايا الجذعية (خلايا الدم غير الناضجة) من الدم أو النخاع العظمي للمتبرع ويتم تجميدها وتخزينها. بعد أن يكمل المريض العلاج الكيميائي والعلاج الإشعاعي ، يتم إذابة الخلايا الجذعية المخزنة وإعطائها للمريض من خلال الحقن في الوريد . تنمو هذه الخلايا الجذعية (وتستعيد) خلايا الدم في الجسم.
نادرًا ما تُستخدم زراعة الخلايا الجذعية كعلاج أولي للأطفال والمراهقين المصابين بمرض ALL. يتم استخدامه في كثير من الأحيان كجزء من العلاج لجميع حالات الانتكاس (يعود بعد العلاج).
راجع الأدوية المعتمدة لسرطان الدم الليمفاوي الحاد لمزيد من المعلومات.
تكبير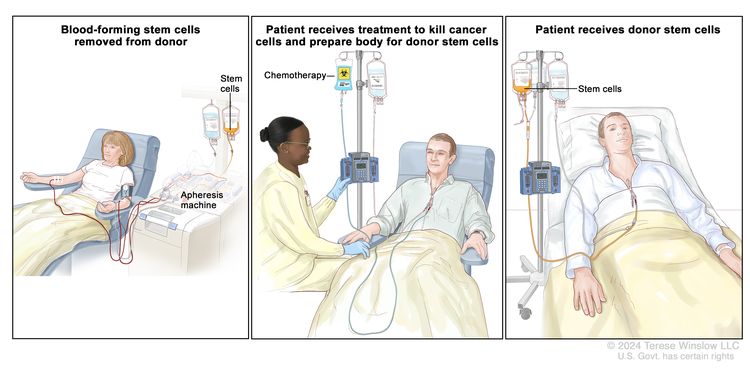 زرع الخلايا الجذعية. (الخطوة 1): يؤخذ الدم من وريد في ذراع المتبرع. يتدفق الدم عبر آلة تزيل الخلايا الجذعية. ثم يُعاد الدم إلى المتبرع من خلال وريد في الذراع الأخرى. (الخطوة الثانية): يتلقى المريض العلاج الكيميائي لقتل الخلايا المكونة للدم. قد يتلقى المريض العلاج الإشعاعي (غير موضح). (الخطوة 3): يتلقى المريض الخلايا الجذعية من خلال قسطرة توضع في وعاء دموي في الصدر.
زرع الخلايا الجذعية. (الخطوة 1): يؤخذ الدم من وريد في ذراع المتبرع. يتدفق الدم عبر آلة تزيل الخلايا الجذعية. ثم يُعاد الدم إلى المتبرع من خلال وريد في الذراع الأخرى. (الخطوة الثانية): يتلقى المريض العلاج الكيميائي لقتل الخلايا المكونة للدم. قد يتلقى المريض العلاج الإشعاعي (غير موضح). (الخطوة 3): يتلقى المريض الخلايا الجذعية من خلال قسطرة توضع في وعاء دموي في الصدر.
العلاج الموجه
العلاج الموجه هو نوع من العلاج يستخدم العقاقير أو المواد الأخرى لتحديد خلايا سرطانية معينة ومهاجمتها. عادةً ما تسبب العلاجات المستهدفة ضررًا أقل للخلايا الطبيعية من العلاج الكيميائي أو العلاج الإشعاعي. هناك أنواع مختلفة من العلاج الموجه:
- علاج مثبطات التيروزين كيناز (TKIs): يمنع هذا العلاج إنزيم التيروزين كيناز ، الذي يتسبب في تطور الخلايا الجذعية إلى خلايا دم بيضاء أكثر مما يحتاجه الجسم. Imatinib mesylate و dasatinib هما TKIs يستخدمان في علاج الأطفال الذين يعانون من كروموسوم فيلادلفيا الموجب ALL. Ruxolitinib هو TKI الذي تتم دراسته في علاج ALL عالية الخطورة المشخصة حديثًا.
- الأجسام المضادة وحيدة النسيلة: هي بروتينات جهاز المناعة تُصنع في المختبر لعلاج العديد من الأمراض ، بما في ذلك السرطان. كعلاج للسرطان ، يمكن لهذه الأجسام المضادة أن ترتبط بهدف محدد على الخلايا السرطانية أو الخلايا الأخرى التي قد تساعد الخلايا السرطانية على النمو. تستطيع الأجسام المضادة بعد ذلك قتل الخلايا السرطانية أو منع نموها أو منعها من الانتشار. يتم إعطاء الأجسام المضادة وحيدة النسيلة عن طريق التسريب. يمكن استخدامها بمفردها أو لنقل الأدوية أو السموم أو المواد المشعة مباشرة إلى الخلايا السرطانية. Blinatumomab
- و inotuzumab هي أجسام مضادة وحيدة النسيلة تجري دراستها في علاج ALL المعند عند الاطفال. تتم دراسة Blinatumomab أيضًا في علاج المخاطر القياسية ALL.
- العلاج بمثبطات البروتوزوم : هذا العلاج هو نوع من العلاج الموجه الذي يمنع عمل البروتيازومات في الخلايا السرطانية. تزيل البروتيازومات البروتينات التي لم تعد الخلية بحاجة إليها. عندما يتم حظر البروتيازومات ، تتراكم البروتينات في الخلية وقد تتسبب في موت الخلية السرطانية. Bortezomib هو نوع من العلاج بمثبطات البروتوزوم المستخدم لعلاج ALL. تتم دراسة Bortezomib أيضًا في علاج المرضى المعرضين للخطر أو المعرضين لمخاطر عالية.
يتم أيضًا دراسة أنواع جديدة من العلاجات المستهدفة في علاج ALL.
راجع الأدوية المعتمدة لسرطان الدم الليمفاوي الحاد لمزيد من المعلومات.
يُعطى العلاج لقتل خلايا سرطان الدم التي انتشرت أو قد تنتشر إلى الدماغ أو النخاع الشوكي أو الخصيتين.
يُطلق على العلاج لقتل خلايا سرطان الدم أو منع انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي ( الجهاز العصبي المركزي ؛ CNS) العلاج الموجه من الجهاز العصبي المركزي. يمكن استخدام العلاج الكيميائي لعلاج خلايا سرطان الدم التي انتشرت أو قد تنتشر إلى الدماغ والحبل الشوكي. نظرًا لأن الجرعات القياسية من العلاج الكيميائي قد لا تعبر الحاجز الدموي الدماغي للوصول إلى السائل الذي يحيط بالمخ والحبل الشوكي للوصول إلى خلايا سرطان الدم في الجهاز العصبي المركزي ، فإن الخلايا قادرة على الاختباء في الجهاز العصبي المركزي. العلاج الكيميائي الجهازي بجرعات عالية أو العلاج الكيميائي داخل القراب (في السائل النخاعي) قادر على الوصول إلى خلايا سرطان الدم في الجهاز العصبي المركزي. في بعض الأحيان يتم إعطاء العلاج الإشعاعي الخارجي للدماغ.
تكبير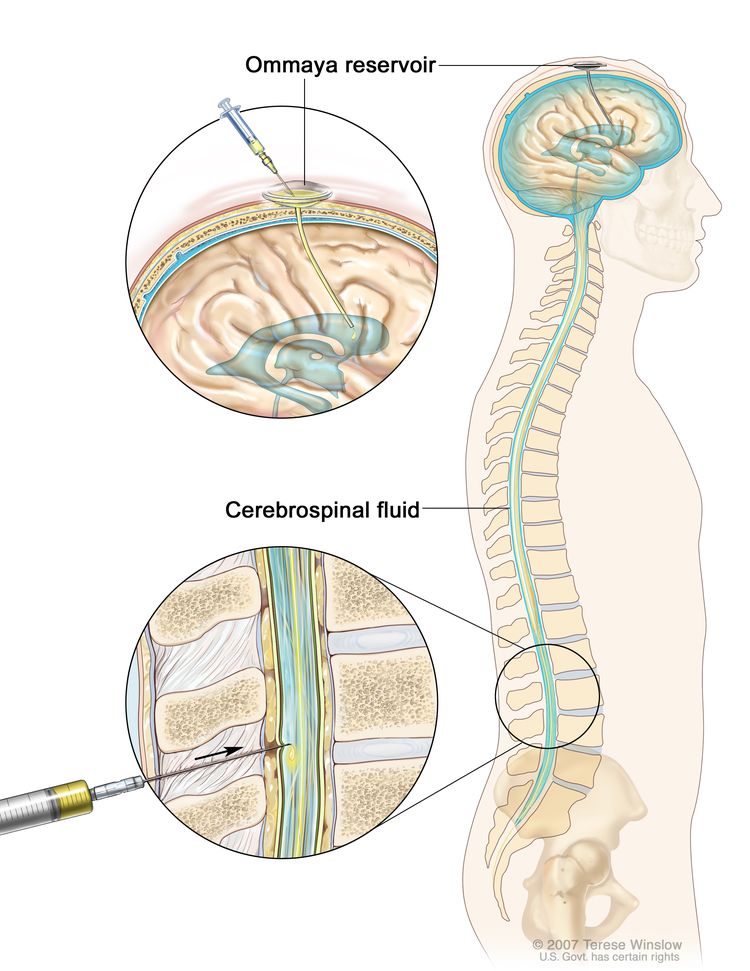 العلاج الكيميائي داخل القراب. تُحقن الأدوية المضادة للسرطان في الفضاء داخل القراب ، وهو الفضاء الذي يحتفظ بالسائل الدماغي النخاعي (CSF ، كما هو موضح باللون الأزرق). هناك طريقتان مختلفتان للقيام بذلك. إحدى الطرق ، كما هو موضح في الجزء العلوي من الشكل ، هي حقن الأدوية في خزان أومايا (وعاء على شكل قبة يوضع تحت فروة الرأس أثناء الجراحة ؛ وهو يحمل الأدوية أثناء تدفقها عبر أنبوب صغير إلى الدماغ ). الطريقة الأخرى ، الموضحة في الجزء السفلي من الشكل ، هي حقن الأدوية مباشرة في السائل النخاعي في الجزء السفلي من العمود الفقري ، بعد تخدير منطقة صغيرة في أسفل الظهر.
العلاج الكيميائي داخل القراب. تُحقن الأدوية المضادة للسرطان في الفضاء داخل القراب ، وهو الفضاء الذي يحتفظ بالسائل الدماغي النخاعي (CSF ، كما هو موضح باللون الأزرق). هناك طريقتان مختلفتان للقيام بذلك. إحدى الطرق ، كما هو موضح في الجزء العلوي من الشكل ، هي حقن الأدوية في خزان أومايا (وعاء على شكل قبة يوضع تحت فروة الرأس أثناء الجراحة ؛ وهو يحمل الأدوية أثناء تدفقها عبر أنبوب صغير إلى الدماغ ). الطريقة الأخرى ، الموضحة في الجزء السفلي من الشكل ، هي حقن الأدوية مباشرة في السائل النخاعي في الجزء السفلي من العمود الفقري ، بعد تخدير منطقة صغيرة في أسفل الظهر.
يتم إعطاء هذه العلاجات بالإضافة إلى العلاج الذي يستخدم لقتل خلايا سرطان الدم في باقي الجسم. يتلقى جميع الأطفال الذين يعانون من ALL علاجًا موجهًا من الجهاز العصبي المركزي كجزء من العلاج المبدئي وعلاج التوحيد / التكثيف وأحيانًا أثناء العلاج الوقائي.
إذا انتشرت خلايا ابيضاض الدم في الخصيتين ، فإن العلاج يشمل جرعات عالية من العلاج الكيميائي الجهازي والعلاج الإشعاعي في بعض الأحيان.
يتم اختبار أنواع جديدة من العلاج في التجارب السريرية.
يصف قسم الملخص هذا العلاجات التي تتم دراستها في التجارب السريرية . قد لا أذكر كل معاملة جديدة قيد الدراسة. تتوفر معلومات حول التجارب السريرية من موقع NCI .
العلاج المناعي لسرطان الدم ALL:
العلاج المناعي هو علاج يستخدم الجهاز المناعي للمريض لمحاربة السرطان. تُستخدم المواد التي يصنعها الجسم أو تُصنع في المختبر لتعزيز أو توجيه أو استعادة دفاعات الجسم الطبيعية ضد السرطان. علاج السرطان هذا هو نوع من العلاج البيولوجي .
- علاج CAR T-cell : يغير هذا العلاج الخلايا التائية للمريض (نوع من خلايا الجهاز المناعي) بحيث يهاجمون بروتينات معينة على سطح الخلايا السرطانية. تؤخذ الخلايا التائية من المريض وتضاف مستقبلات خاصة إلى أسطحها في المختبر. تسمى الخلايا المتغيرة الخلايا التائية لمستقبلات المستضد الخيمري (CAR). تزرع خلايا CAR T في المختبر وتُعطى للمريض عن طريق التسريب. تتكاثر خلايا CAR T في دم المريض وتهاجم الخلايا السرطانية. تتم دراسة العلاج بالخلايا التائية CAR في علاج ALL ، وكل ما حدث الانتكاس (عاد) مرة ثانية.
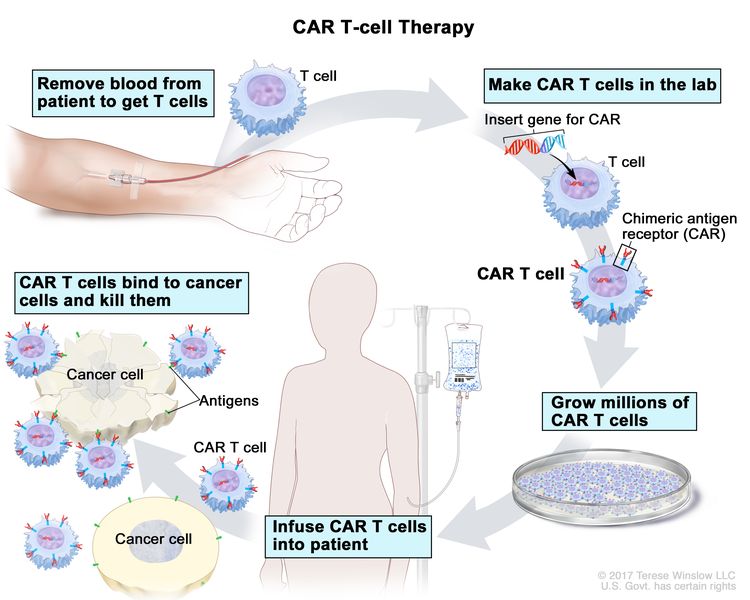 العلاج بالخلايا التائية CAR. نوع من العلاج يتم فيه تغيير الخلايا التائية للمريض (نوع من الخلايا المناعية) في المختبر بحيث ترتبط بالخلايا السرطانية وتقتلها. يتدفق الدم من الوريد في ذراع المريض عبر أنبوب إلى جهاز فصادة (غير موضح) ، والذي يزيل خلايا الدم البيضاء ، بما في ذلك الخلايا التائية ، ويرسل باقي الدم إلى المريض. بعد ذلك ، يتم إدخال الجين الخاص بمستقبل خاص يسمى مستقبل المستضد الكيميري (CAR) في الخلايا التائية في المختبر. تزرع الملايين من خلايا CAR T في المختبر ثم تُعطى للمريض عن طريق التسريب. خلايا CAR T قادرة على الارتباط بمستضد على الخلايا السرطانية وقتلها.
العلاج بالخلايا التائية CAR. نوع من العلاج يتم فيه تغيير الخلايا التائية للمريض (نوع من الخلايا المناعية) في المختبر بحيث ترتبط بالخلايا السرطانية وتقتلها. يتدفق الدم من الوريد في ذراع المريض عبر أنبوب إلى جهاز فصادة (غير موضح) ، والذي يزيل خلايا الدم البيضاء ، بما في ذلك الخلايا التائية ، ويرسل باقي الدم إلى المريض. بعد ذلك ، يتم إدخال الجين الخاص بمستقبل خاص يسمى مستقبل المستضد الكيميري (CAR) في الخلايا التائية في المختبر. تزرع الملايين من خلايا CAR T في المختبر ثم تُعطى للمريض عن طريق التسريب. خلايا CAR T قادرة على الارتباط بمستضد على الخلايا السرطانية وقتلها.
قد يتسبب علاج ابيضاض الدم الليمفاوي الحاد في مرحلة الطفولة في حدوث آثار جانبية.
للحصول على معلومات حول الآثار الجانبية التي تبدأ أثناء علاج السرطان ، راجع صفحة الآثار الجانبية .
تعتبر فحوصات المتابعة المنتظمة مهمة للغاية. تسمى الآثار الجانبية لعلاج السرطان التي تبدأ بعد العلاج وتستمر لأشهر أو سنوات بالآثار المتأخرة .
قد تشمل الآثار المتأخرة لعلاج السرطان ما يلي:
- المشاكل الجسدية ، بما في ذلك مشاكل القلب والأوعية الدموية والكبد أو العظام والخصوبة .
- عندما يتم إعطاء ديكسرازوكسان مع أدوية العلاج الكيميائي المسماة أنثراسيكلين ، يقل خطر الإصابة بآثار القلب المتأخرة.
- تغيرات في المزاج أو المشاعر أو التفكير أو التعلم أو الذاكرة. الأطفال الذين تقل أعمارهم عن 4 سنوات والذين تلقوا العلاج الإشعاعي للدماغ لديهم مخاطر أكبر من هذه الآثار.
- السرطانات الثانية (أنواع جديدة من السرطان) أو حالات أخرى ، مثل أورام المخ وسرطان الغدة الدرقية وسرطان الدم النخاعي الحاد ومتلازمة خلل التنسج النقوي .
يمكن معالجة بعض التأثيرات المتأخرة أو السيطرة عليها. من المهم التحدث مع أطباء طفلك حول الآثار المتأخرة المحتملة التي تسببها بعض العلاجات. انظر ملخص PDQ عن الآثار المتأخرة لعلاج سرطان الأطفال .
قد يرغب المرضى في التفكير في المشاركة في تجربة سريرية.
بالنسبة لبعض المرضى ، قد تكون المشاركة في تجربة سريرية هي الخيار الأفضل للعلاج. التجارب السريرية هي جزء من عملية البحث السرطان. يتم إجراء التجارب السريرية لمعرفة ما إذا كانت علاجات السرطان الجديدة آمنة وفعالة أم أفضل من العلاج القياسي .
تستند العديد من العلاجات القياسية للسرطان اليوم إلى تجارب إكلينيكية سابقة. قد يتلقى المرضى الذين يشاركون في تجربة سريرية العلاج القياسي أو يكونون من بين أول من يتلقون علاجًا جديدًا.
يساعد المرضى الذين يشاركون في التجارب السريرية أيضًا في تحسين طريقة علاج السرطان في المستقبل. حتى عندما لا تؤدي التجارب السريرية إلى علاجات جديدة فعالة ، فإنها غالبًا ما تجيب على أسئلة مهمة وتساعد في دفع البحث إلى الأمام.
يمكن للمرضى الدخول في التجارب السريرية قبل أو أثناء أو بعد بدء علاج السرطان.
تتضمن بعض التجارب السريرية فقط المرضى الذين لم يتلقوا العلاج بعد. تختبر التجارب الأخرى العلاجات للمرضى الذين لم يتحسن مرض السرطان لديهم. هناك أيضًا تجارب سريرية تختبر طرقًا جديدة لمنع تكرار السرطان (العودة) أو تقليل الآثار الجانبية لعلاج السرطان.
تجرى التجارب السريرية في أجزاء كثيرة من البلاد. يمكن العثور على معلومات حول التجارب السريرية التي يدعمها NCI على صفحة الويب الخاصة ببحث التجارب السريرية الخاصة بـ NCI . يمكن الاطلاع على التجارب السريرية التي تدعمها المنظمات الأخرى على موقع ClinicalTrials.gov .
قد تكون هناك حاجة لاختبارات المتابعة.
قد تتكرر بعض الاختبارات التي تم إجراؤها لتشخيص السرطان أو لمعرفة مرحلة السرطان. سيتم تكرار بعض الاختبارات لمعرفة مدى نجاح العلاج. قد تستند القرارات المتعلقة بمواصلة العلاج أو تغييره أو إيقافه إلى نتائج هذه الاختبارات.
سيستمر إجراء بعض الاختبارات من وقت لآخر بعد انتهاء العلاج. يمكن أن تظهر نتائج هذه الاختبارات ما إذا كانت حالة طفلك قد تغيرت أو إذا تكرر السرطان (عاد). تسمى هذه الاختبارات أحيانًا اختبارات المتابعة أو الفحوصات.
يتم إجراء شفط وخزعة نخاع العظم خلال جميع مراحل العلاج لمعرفة مدى نجاح العلاج.
علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (خطر عادي)
للحصول على معلومات حول العلاجات المدرجة أدناه ، راجع قسم نظرة عامة على خيار العلاج .
علاج سرطان الدم الليمفاوي الحاد (ALL) الذي تم تشخيصه حديثًا بمخاطر قياسية في مرحلة الطفولة
أثناء :
يشمل دائمًا العلاج الكيميائي المركب . عندما يكون الأطفال الذين يعانون من ضعف الاستجابة للعلاج في حالة هجوع بعد العلاج المبدئي لإحداث الهجوع ، فإن زرع الخلايا الجذعية باستخدام الخلايا الجذعية من متبرعقد يتم ذلك. عندما لا يكون الأطفال الذين يعانون من ضعف الاستجابة للعلاج في حالة هجوع بعد العلاج الأولي للهجوع ، فعادة ما يكون العلاج الإضافي هو نفس العلاج الذي يُعطى للأطفال الذين يعانون من ابيضاض الدم اللمفاوي الحاد (ALL) شديد الخطورة .
يتم إعطاء العلاج الكيميائي داخل القراب لمنع انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي .
تشمل العلاجات التي تتم دراستها في التجارب السريرية لـ ALL ذات المخاطر القياسية العلاج الكيميائي المركب مع أو بدون العلاج الموجه مع الأجسام المضادة أحادية النسيلة ( blinatumomab ).
استخدم بحثنا في التجارب السريرية للعثور على التجارب السريرية للسرطان المدعومة من المعهد الوطني للسرطان والتي تقبل المرضى. يمكنك البحث عن التجارب بناءً على نوع السرطان وعمر المريض ومكان إجراء التجارب. تتوفر أيضًا معلومات عامة حول التجارب السريرية.
علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (مخاطر عالية)
للحصول على معلومات حول العلاجات المدرجة أدناه ، راجع قسم نظرة عامة على خيار العلاج .
يشمل علاج سرطان الدم الليمفاوي الحاد الذي تم تشخيصه حديثًا عالي الخطورة (ALL)
أثناء مراحل:
يتم إعطاء الأطفال في مجموعة ALL عالية الخطورة المزيد من الأدوية المضادة للسرطان وجرعات أعلى من الأدوية المضادة للسرطان ، خاصة خلال مرحلة التوحيد / التكثيف ، مقارنة بالأطفال في مجموعة المخاطر القياسية.
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي . في بعض الأحيان يتم إعطاء العلاج الإشعاعي للدماغ أيضًا.
تشمل العلاجات التي تتم دراستها في التجارب السريرية لـ ALL عالية المخاطر نظم علاج كيميائي جديدة مع أو بدون علاج موجه أو زرع خلايا جذعية . يتم أيضًا دراسة العلاج بالخلايا التائية بمستقبلات المستضد الكيميري (CAR) .
استخدم بحثنا في التجارب السريرية للعثور على التجارب السريرية للسرطان المدعومة من المعهد الوطني للسرطان والتي تقبل المرضى. يمكنك البحث عن التجارب بناءً على نوع السرطان وعمر المريض ومكان إجراء التجارب. تتوفر أيضًا معلومات عامة حول التجارب السريرية.
علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (خطورة عالية جدًا)
للحصول على معلومات حول العلاجات المدرجة أدناه ، راجع قسم نظرة عامة على خيار العلاج .
علاج سرطان الدم الليمفاوي الحاد (ALL) الذي تم تشخيصه حديثًا وعالي الخطورة جدًا
أثناء تحريض
يشمل دائمًا العلاج الكيميائي المركب . يتم إعطاء الأطفال في مجموعة ALL عالية الخطورة عقاقير مضادة للسرطان أكثر من الأطفال في المجموعة المعرضة للخطر. ليس من الواضح ما إذا كانت زراعة الخلايا الجذعية خلال فترة الهدأة الأولى ستساعد الطفل على العيش لفترة أطول.
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي . في بعض الأحيان يتم إعطاء العلاج الإشعاعي للدماغ أيضًا.
تشمل العلاجات التي تتم دراستها في التجارب السريرية لجميع الحالات عالية الخطورة أنظمة علاج كيميائي جديدة مع أو بدون علاج موجه .
استخدم بحثنا في التجارب السريرية للعثور على التجارب السريرية للسرطان المدعومة من المعهد الوطني للسرطان والتي تقبل المرضى. يمكنك البحث عن التجارب بناءً على نوع السرطان وعمر المريض ومكان إجراء التجارب. تتوفر أيضًا معلومات عامة حول التجارب السريرية.
علاج سرطان الدم الليمفاوي الحاد لدى الأطفال (مجموعات خاصة)
في هذا القسم
- سرطان الدم الليمفاوي الحاد في مرحلة الطفولة من الخلايا التائية
- الرضع مع ALL
- الأطفال بعمر 10 سنوات فما فوق والمراهقون المصابون بمرض ALL
- كروموسوم فيلادلفيا - إيجابي ALL
للحصول على معلومات حول العلاجات المدرجة أدناه ، راجع قسم نظرة عامة على خيار العلاج .
سرطان الدم الليمفاوي الحاد في مرحلة الطفولة من الخلايا التائية
علاج سرطان الدم الليمفاوي الحاد في مرحلة الطفولة (T-ALL) الذي تم تشخيصه حديثًا بالخلايا التائية (T-ALL)
أثناء مراحل :
يشمل دائمًا العلاج الكيميائي المركب . يُعطى الأطفال المصابون بمرض T-ALL المزيد من الأدوية المضادة للسرطان وجرعات أعلى من الأدوية المضادة للسرطان مقارنة بالأطفال في مجموعة المخاطر المعيارية التي تم تشخيصها حديثًا.
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي . في بعض الأحيان يتم إعطاء العلاج الإشعاعي للدماغ أيضًا.
علاج ALL عند الرضع:
إن علاج الأطفال الذين تم تشخيصهم حديثًا بالـ ALL أثناء تحريض الهوادة ، والتوحيد / التكثيف ، والمداومة
يشمل دائمًا العلاج الكيميائي المركب . يُعطى الأطفال المصابون بـ ALL عقاقير مختلفة مضادة للسرطان وجرعات أعلى من الأدوية المضادة للسرطان مقارنة بالأطفال الذين تبلغ أعمارهم سنة واحدة أو أكثر في مجموعة المخاطر القياسية. ليس من الواضح ما إذا كانت زراعة الخلايا الجذعية خلال فترة الهدأة الأولى ستساعد الطفل على العيش لفترة أطول.
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي .
تشمل العلاجات التي تتم دراستها في التجارب السريرية للرضع المصابين بمرض ALL العلاج الكيميائي للرضع الذين يعانون من تغير جيني معين.
الأطفال بعمر 10 سنوات فما فوق والمراهقون المصابون بمرض ALL
يشمل علاج حالات ALL التي تم تشخيصها حديثًا في الأطفال والمراهقين (10 سنوات فما فوق) أثناء مراحل:
يُعطى الأطفال الذين تبلغ أعمارهم 10 سنوات وما فوق والمراهقون المصابون بداء ALL معززًا أدوية أكثر مضادًا للسرطان وجرعات أعلى من الأدوية المضادة للسرطان مقارنة بالأطفال في مجموعة المخاطر القياسية.
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي . في بعض الأحيان يتم إعطاء العلاج الإشعاعي للدماغ أيضًا.
تشمل العلاجات التي تتم دراستها في التجارب السريرية للأطفال 10 سنوات فما فوق والمراهقين الذين يعانون من ALL عوامل جديدة مضادة للسرطان وأنظمة العلاج الكيميائي مع أو بدون علاج موجه . يتم أيضًا دراسة العلاج بالخلايا التائية بمستقبلات المستضد الكيميري (CAR) .
علاج ALL مع كروموسوم فيلادلفيا - إيجابي :
قد يشمل علاج حالات ALL الإيجابية لكروموسوم فيلادلفيا الذي تم تشخيصه حديثًا خلال مراحل تحريض الهدوء ، والتوحيد / التكثيف ، والمداومة ما يلي:
- الجمع بين العلاج الكيميائي والعلاج الموجه باستخدام :
يتم إعطاء العلاج الكيميائي داخل القراب والجهاز لمنع أو علاج انتشار خلايا سرطان الدم إلى الدماغ والحبل الشوكي .
العلاجات التي تتم دراستها في التجارب السريرية للطفولة الإيجابية لكروموسوم فيلادلفيا تشمل جميعها نظامًا جديدًا للعلاج الموجه (إيماتينيب ميسيلات) والعلاج الكيميائي المركب مع أو بدون زرع الخلايا الجذعية.
استخدم بحثنا في التجارب السريرية للعثور على التجارب السريرية للسرطان المدعومة من المعهد الوطني للسرطان والتي تقبل المرضى. يمكنك البحث عن التجارب بناءً على نوع السرطان وعمر المريض ومكان إجراء التجارب. تتوفر أيضًا معلومات عامة حول التجارب السريرية.
علاج سرطان الدم الليمفاوي الحاد المقاومة للعلاج أو حالات الانتكاس في مرحلة الطفولة
للحصول على معلومات حول العلاجات المدرجة أدناه ، راجع قسم نظرة عامة على خيار العلاج .
قد يشمل العلاج القياسي لسرطان الدم الليمفاوي الحاد في مرحلة الطفولة (ALL) الذي يعود إلى النخاع العظمي ما يلي:
- العلاج الكيميائي المركب مع العلاج الموجه أو بدونه ( بورتيزوميب ).
- زرع الخلايا الجذعية باستخدام الخلايا الجذعية من المتبرع .
لا يوجد علاج قياسي لعلاج حالات ALL المعندة.
قد تشمل العلاجات الأخرى لحالات ALL للطفولة المقاومة للعلاج أو الانتكاس ALL ما يلي:
العلاج القياسي للطفولة المنكسة قد يشمل كل ما يأتي خارج النخاع العظمي ما يلي:
- العلاج الكيميائي الجهازي والعلاج الكيميائي داخل القراب مع العلاج الإشعاعي للدماغ و / أو النخاع الشوكي للسرطان الذي يعود إلى الدماغ والحبل الشوكي فقط.
- زرع الخلايا الجذعية للسرطان الذي تكرر في الدماغ و / أو النخاع الشوكي.
- الجمع بين العلاج الكيميائي والعلاج الإشعاعي للسرطان الذي يعود في الخصيتين فقط.
تتضمن بعض العلاجات التي تتم دراستها في التجارب السريرية للطفولة المنكسة ALL ما يلي:
- نظام جديد من العلاج الكيميائي المركب والعلاج الموجه (بلييناتوموماب).
- نوع جديد من أدوية العلاج الكيميائي.
- العلاج بالخلايا التائية CAR.
References
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- Childhood cancer. In: Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2010. National Cancer Institute, 2013, Section 28. Also available online. Last accessed March 30, 2022.
- Childhood cancer by the ICCC. In: Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2010. National Cancer Institute, 2013, Section 29. Also available online. Last accessed March 30, 2022.
- Howlader N, Noone AM, Krapcho M: SEER Cancer Statistics Review (CSR) 1975-2013. Bethesda, Md: National Cancer Institute, 2015. Available online. Last accessed June 04, 2021.
